基本信息
|
姓名 |
性别 |
专业情况 |
职务 |
单位 |
|
杜金刊 |
男 |
医学伦理学/主任医师 |
主任委员 |
东阳市人民医院 |
|
金桂龙 |
男 |
医学管理/主任医师 |
常务副主任委员 |
东阳市人民医院 |
|
徐星娥 |
女 |
药学/主任药师 |
副主任委员 |
东阳市人民医院 |
|
王茂峰 |
男 |
检验医学/博士 |
副主任委员 |
东阳市人民医院 |
|
厉剑锋 |
男 |
骨科/副主任医师 |
委员 |
东阳市人民医院 |
|
赵福成 |
男 |
农学博士/副所长 |
委员 |
浙江省农科院玉米研究所 |
|
单爱萍 |
女 |
律师/主任 |
委员 |
浙江聚象律师事务所 |
|
金艳华 |
女 |
眼科/主任医师 |
委员 |
东阳市人民医院 |
|
吴春晓 |
女 |
麻醉/副主任医师 |
委员 |
东阳市人民医院 |
|
吴代强 |
男 |
呼吸/副主任医师 |
委员 |
东阳市人民医院 |
|
刘志英 |
女 |
中医/主任中医师 |
委员 |
东阳市人民医院 |
|
王霞飞 |
女 |
肾病学/主任医师 |
委员 |
东阳市人民医院 |
|
周长春 |
男 |
泌尿外科/主任医师 |
委员 |
东阳市人民医院 |
|
郭晓丽 |
女 |
妇科/副主任医师 |
委员 |
东阳市人民医院 |
|
蔡忠芳 |
女 |
肿瘤放疗/主任医师 |
委员 |
东阳市人民医院 |
|
任琅 |
女 |
感染科/副主任医师 |
委员 |
东阳市人民医院 |
|
葛萱 |
女 |
心内/主任医师 |
委员 |
东阳市人民医院 |
|
何菊萍 |
女 |
神内/主任医师 |
委员 |
东阳市人民医院 |
|
赵小康 |
男 |
外科/副主任医师 |
委员 |
东阳市人民医院 |
|
赵璐萍 |
女 |
药学/主管药师 |
秘书 |
东阳市人民医院 |
|
陈超 |
女 |
药学/主管药师 |
秘书 |
东阳市人民医院 |
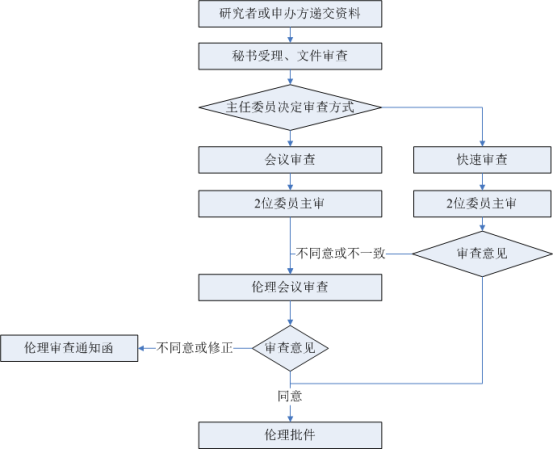
临床研究伦理审查申请/报告指南
流程图
文件下载
法律法规下载
参考资料
国家食品药品监督管理局.《药物临床试验质量管理规范》,2020
国家食品药品监督管理总局.《医疗器械临床试验质量管理规范》,2022
国家食品药品监督管理局.《体外诊断试剂注册管理办法(试行)》,2007
国家食品药品监督管理局.《药物临床试验伦理审查工作指导原则》,2010
国家食品药品监督管理局.《医疗器械监督管理条例》,2000年
中国卫生部.《涉及人的生物医学研究伦理审查办法(试行)》,2016
中国卫生部.《医疗技术临床应用管理办法》,2009
WMA. Declaration of Helsinki, Ethical Principles for Medical Research Involving Human Subjects,2013
WHO. Operational Guidelines for Ethics Committees That Review Biomedical Research,2000
CIOMS.International Ethical Guidelines for Biomedical Research Involving Human Subjects,2002
ICH.Guideline For Good Clinical Practice,1996
关于我们
地址:东阳市吴宁西路60号 医院总机:0579-86856999
医患关系:0579-86856751 院办:0579-86856789
党办:0579-86856778